Цены на услуги
- Генетика
- Манипуляции
- Введение сперматозоида в ооцит, ПИКСИ (дополнительно к ИКСИ)
12 000 руб.
Внимание! Цены на сайте могут отличаться.
Пожалуйста, уточняйте актуальную стоимость у администраторов по телефону.
Наши специалисты:
ГлинкинаЖанна Ивановна
Лабораторный генетик
Доктор биологических наук
Другие болезни которые мы лечим
Услуги Раскрыть
Генетическая диагностика предрасположенности к онкологическим заболеваниям
Генетические причины бесплодия (мужского и женского)
Генетическое исследование клеток ворсин хориона неразвивающейся беременности
Методы преимплантационной генетической диагностики
Неинвазивное определение пола плода, резус-фактора и хромосомных аномалий (тест NACE)
Неинвазивный пренатальный генетический тест NACE
Сравнительная геномная гибридизация
Тест ALICE (ЭЛИС)
Тест ERA
Установление отцовства и степени родства
Акции госпиталя
Акции
Скидки на приемы до 70%
09.02.2022
Акции
Бесплатное тестирование на Covid-19
02.11.2021
Акции
Скидка на каждое пятое посещение
11.06.2021
ВСЕ АКЦИИ
Наши программы
Чек-апы возрастные
Ознакомится >
Чек-апы по направлениям
Ознакомится >
Детокс после праздников
Ознакомится >
ВСЕ ПРОГРАММЫ
Преимущества клиники
200 человек специалистов
Более 35 000
довольных клиентов
Имеется стационар
на 15 койко-мест
Площадь клиники
4500 м2
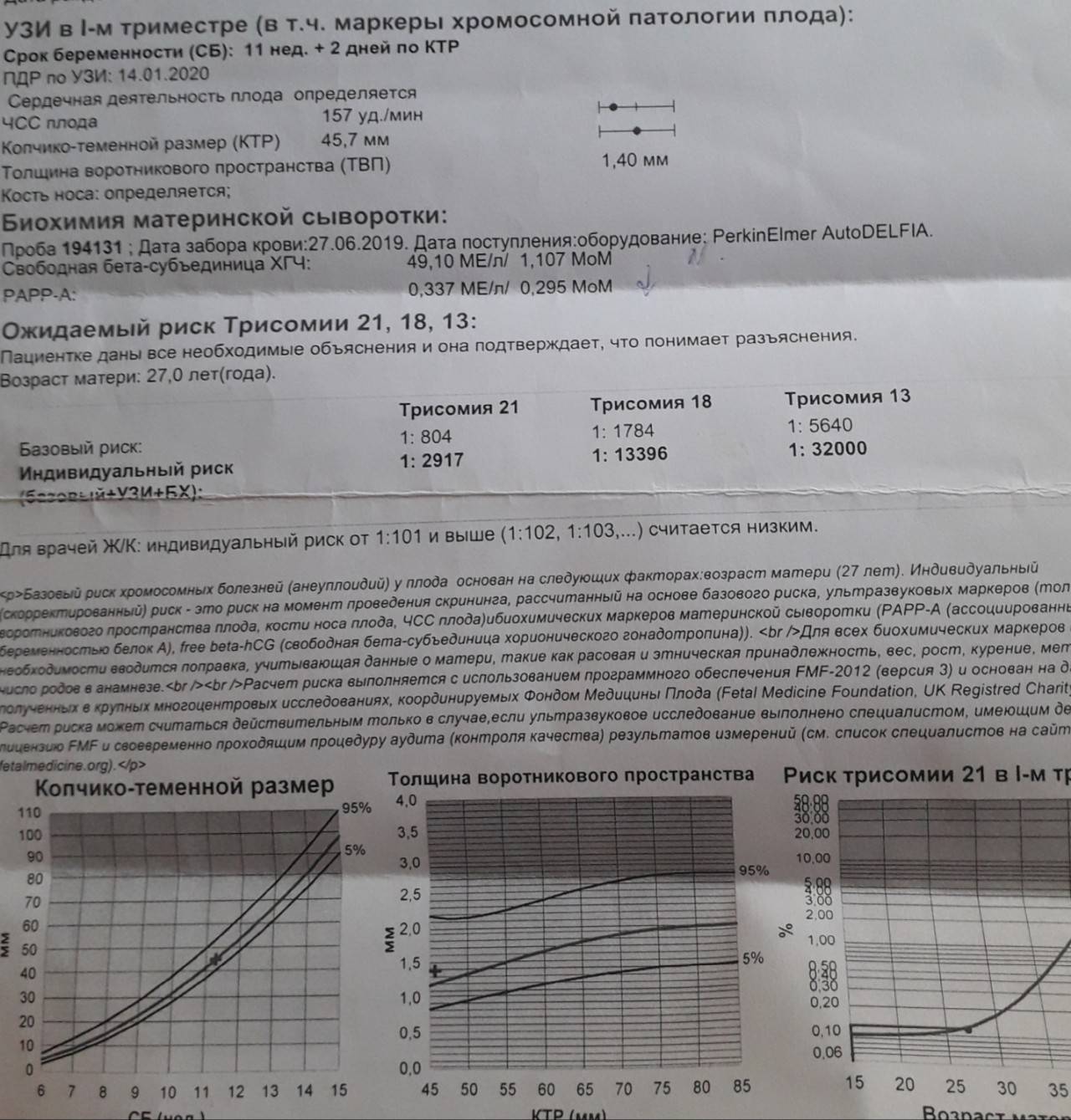
Хромосомная патология – синдром Шерешевского-Тернера
Риск хромосомной патологии плода – синдрома Шерешевского-Тернера составляет 1 к 3500. Кариотип заболевания – 45.Х. Характеризуется патология антимонголоидным разрезом глаз, в 65% случаев встречается лимфатический отек стоп, голеней, кистей рук у новорожденного младенца, которые могут проявляться в течении первых месяцев жизни малыша. Патология имеет выраженные признаки – короткая шея, которая встречается в половине случаев патологии, крыловидные складки (шея сфинкса) от затылка до надплечья, встречаются в 65% случаев заболевания. У всех детей с синдромом Шерешевского-Тернера маленький рост, бочкообразная грудь с широко расставленными сосками встречается в 55% случаев. При кариотипе 45.Х у всех больных детей диагностируется половой инфантилизм. Патология характеризуется недоразвитием молочных желез, аменореей, эмоциональной бедностью. Патологию лечат стимуляцией роста ребенка, формированием менструального цикла с помощью гормональной терапии, по показаниям применяют хирургическое лечение, психотерапевтическое лечение.
Расшифровка анализа
Результаты анализа расшифровывает, в первую очередь, акушер-гинеколог, ведущий беременность; получение нормальных или низких показателей риска не требует специальных знаний для расшифорвки. Если же результаты тестов оказались неблагоприятными, генетик и врач-акушер-гинеколог обязаны тщательно изучить результаты пренатального скрининга и согласовать их с семейной парой; специалисты информируют родителей о возможных рисках. При необходимости генетик назначает консультацию врача, который занимается лечением конкретной генетической аномалии, или врача-перинатолога, который ведет сложные беременности. Помощь специалиста позволяет будущим родителям подготовиться к рождению ребенка и изучить все тонкости постнатального периода.
Методами инвазивного (нехирургического) обследования беременных являются: биопсия хориона (предшественника плаценты), амниоцентез, кордоцентез (взятие крови из пуповины), а также редкие – биопсия кожи плода и эмбриоскопия. Их используют только в случае высокой вероятности развития генетического дефекта и аномалий.
Ультразвуковые маркеры
Врач ультразвуковой диагностики должен быть предупрежден о полученных результатах биохимического скрининга (и предыдущих ультразвуковых исследований)
Специалист УЗИ обращает внимание на размер воротниковой складки, копчиково-теменной размер, частоту сердцебиения плода, состояние лицевого скелета, длины трубчатых костей, состояние мочевого пузыря, почек, кишечника, количество околоплодных вод. Любые отклонения в ультразвуковой картине могут говорить о наличии генетической патологии и должны быть оценены ведущим беременность акушером-гинекологом и генетиком.
Маркеры крови
При стандартном скрининге берут два показателя крови:
Ассоциированный с беременностью протеин-А (PAPP-A);
Свободный хорионический гонадотропин (бетта-фракция).
Эти показатели зависят от срока беременности; диапазон нормы широкий и зависит от многих обстоятельств, в т.ч. от региона проживания. При расчете учитываются данные анамнеза, и такой расчет позволяет более точно определить вероятность патологии плода.
Методы диагностики хромосомной аномалии
Хромосомные аномалии могут быть диагностированы неинвазивными и инвазивными методами. Первые позволяют установить ряд патологий, характерных для хромосомных аномалий. Инвазивные методы используются для постановки точного диагноза.
УЗИ
Установление риска синдрома Дауна у плода на УЗИ называют ультразвуковым скринингом. Часто метод используется в комплексе с биохимическим анализом крови матери. Точность диагностики синдрома Дауна на УЗИ во втором триместре беременности может достигать 91%. Обследование проводится на 11-13 и 16-18 неделе беременности.
Инвазивные методики
Инвазивная пренатальная диагностика может повлечь ряд осложнений. Риск для плода и матери небольшой. Тем не менее, процедуру назначают только в случае необходимости, если синдром Дауна у плода подтверждают данные УЗИ и анализа крови матери.
Биохимический скрининг
Главная задача скрининга заключается в выявлении групп риска с точки зрения рождения ребенка с тяжелыми заболеваниями, в том числе с хромосомными нарушениями. Биохимический скрининг рекомендуется проходить всем женщинам в первом и втором триместрах беременности.
Проведение диагностики в I триместре беременности
В первом триместре беременности синдром Дауна может быть диагностирован на УЗИ, благодаря наличию ряда патологий. К ним относится повышенная толщина воротникового пространства у плода, уменьшенные, по сравнению с нормой, размеры мозжечка и лобной доли, нарушение формирования костей, пороки сердца, отсутствие носовой кости и т
д.Важно помнить, что ни один маркер не будет считаться достаточным для надежной диагностики синдрома Дауна – только данных УЗИ для этого мало. Поэтому, получив результаты обследования, не нужно расстраиваться раньше времени – необходимо проконсультироваться у специалиста.
Виды пренатального тестирования
Пренатальное тестирование делится на две группы:
- неинвазивное;
- инвазивное.
В первую входят тесты, которые чаще всего проводят при каждой беременности, независимо от факторов риска пороков развития. Это:
- УЗИ — пренатальное УЗИ;
- биохимические исследования крови матери.
Существуют также неинвазивные скрининговые тесты (тест PAPP-A), которые могут выявить синдром Дауна, а также синдромы Эдвардса и Патау.
В соответствующий период беременности — от 11 до 13 недель и 6 дней беременности — также проводится ультразвуковое исследование для оценки дефектов и анализ крови для измерения уровня белка PAPP-A и свободного бета-ХГЧ.
Причины патологий плода: что влияет на рождение детей с генетическими отклонениями
К фактором, способствующим рождению детей с генетическими аномалиями, относятся:
- Генетическая предрасположенность. Гены — это информация, закладываемая от обоих родителей. Определяются такие показатели, как рост, цвет глаз и волос. Точно также закладываются и различные отклонения, если у обоих или у одного из родителей имеется повреждённый ген. Вот почему запрещается вступать в брак близким родственникам. Ведь тогда возрастает вероятность вынашивания плода с генетической патологией. С партнером, имеющим противоположный генетический набор, больше шансов родить здорового малыша.
- Возраст родителей. К группе риска относятся мамы старше 35 лет и папы старше 40 лет. С возрастом снижается иммунитет, возникают хронические заболевания, и иммунная система женщины попросту «не заметит» генетически повреждённого сперматозоида. Произойдёт зачатие, и, если у молодой женщины организм сам отторгнет неполноценный плод, у возрастной мамы беременность будет проходить более спокойно.
- Вредные привычки мамы. Практически 90% патологических беременностей проходит при маловодии. У курящей женщины плод страдает от гипоксии, продукты распада альдегидов (спиртов) на начальных сроках беременности приводят к мутациям и отклонениям. У алкоголичек в 46% случаев дети рождаются с генетическими патологиями. Спирты также «ломают» генетические цепочки и у отцов, которые любят выпить.
- Инфекции. Особенно опасны такие заболевания, как грипп, краснуха, ветрянка. Наиболее уязвимым плод является до 18-й недели, пока не сформируется околоплодный пузырь. В некоторых случаях женщине предлагают сделать аборт.
- Приём медикаментов. Даже обычный ромашковый чай для беременной женщины является токсичным. Любой приём лекарств должен сопровождаться консультацией врача.
- Эмоциональные потрясения. Они вызывают гибель нервных клеток, что неизменно сказывается на развитии плода.
- Плохая экология и смена климата. Забеременев во время отдыха на Таиланде, есть вероятность вместе с беременностью привезти опасную инфекцию, которая в родных краях начнет медленно развиваться, сказываясь на здоровье малыша.
Патологии печени у плода
Печень визуализируется на ультразвуковом обследовании уже на 1-м скрининге. На сроке 11-14 недель можно увидеть в верхней части брюшной полости гипоэхогенное образование в виде месяца. К 25 неделе эхогенность повышается и становится такой же, как у кишечника, а перед родами превышает по плотности кишечник.
Очень важна оценка состояния кровотока печени. Вена пуповины плода входит в печень, во 2 триместре визуализируется воротная вена. Её диаметр в норме равен 2-3 мм, а к родам увеличивается до 10-11 мм. Желчные протоки в норме визуализироваться у плода не должны. Одна из часто встречающихся патологий плода — гепатомегалия печени — увеличение размеров органа. Для выявления аномалии применяется 3D датчик, способный визуализировать срез в продольном, поперечном и вертикальном срезах. Также можно увидеть увеличение размеров печени и на обычном УЗИ аппарате по выступающему животику, охват которого значительно превышает норму.
Одновременно с этим на экране видны различные гиперэхогенные включения. Как правило, аномалия дополняется увеличением селезёнки.
Среди причин, приводящих к увеличению размеров органов пищеварения, выделяют скрытые инфекции (токсоплазмоз, сифилис, ветрянка), а также хромосомные мутации (синдромы Дауна, Зельвегера, Беквета-Видемана).
- При синдроме Зельвегера видны аномалии конечностей, искажение грудной клетки, кисты почек. Анализ амниотических вод выявляет нехватку дигидрокси-ацетон-фосфат-ацил-трансферазы.
- Ветряная оспа, герпес, цитомегаловирус вызывают кальцинирование тромбов печёночной вены, что отражается на экране УЗИ монитора гиперэхогенными кальцинатами круглой формы. Также они образуются при мекониевом перитоните — отравлении содержимым кишечника плода, которое попадает в результате повреждения стенок.
В 87,5% случаев причиной увеличения печени и образования кальцификатов являются внутриутробные инфекции. Также у большинства беременных диагностируется гиперэхогенный кишечник, изменение структуры плаценты, а также большие размеры селезёнки. Патология на 3 триместре возникает в случае резус-конфликта между матерью и ребёнком. Также не исключены и метаболические нарушения. Увеличение печени встречается при галактоземии (генетическое нарушением углеводного обмена, из-за которого галактоза не преобразуется в глюкозу), трипсинемии (отсутствия выработки пищеварительного гормона трипсина), метилмалоновой ацидемии (отсутствии превращения D-метилмалоновой кислоты в янтарную кислоту), нарушениях выделения мочевины. Одиночные гиперэхогенные включения большого размера гораздо лучше, чем множественные разрозненные образования в сочетании с другими патологиями. Практически в 100% случаев гиперэхогенные включения большого размера устраняются до рождения малыша или в первый год жизни. В некоторых случаях порок органов брюшной полости ставится ошибочно. Такое бывает, если брюшная полость малыша сдавливается стенками матки, патологиях миометрия или других факторах.
На экране монитора видна псевдоомфалоцеле — ошибочная визуализация выхода органов брюшной полости за пределы брюшной стенки. Иногда УЗИ «не видит» значительных пороков. Так, грыжа по форме и эхоструктуре напоминает петли кишечника, в этом плане большую помощь оказывает допплерометрия, позволяющая увидеть кровоток.
Наша клиника имеет прекрасный 4D аппарат, оснащённый всеми современными возможностями, исключающими ошибки диагностики.
Генетические пренатальные исследования
Можно проводить генетические тесты плода с использованием ДНК клеток плода, присутствующих в крови матери (метод NIFTY). Кровь матери берется между 10 и 24 неделями беременности.
 Генетические пренатальные исследования
Генетические пренатальные исследования
Обследование выявляет:
- синдром Дауна (трисомия 21);
- синдром Эдвардса (трисомия 18);
- Патау (трисомия 13);
- хромосомные врожденные аномалии, например синдром Тернера, синдром Клайнфельтера.. Примером такого исследования является тест Panorama или Veragene.
Пренатальная диагностика включает наблюдение за развитием беременности и плода с помощью соответствующих методов, например, ультразвука. Благодаря этому мы можем своевременно обнаружить возможные осложнения и провести соответствующее лечение.
Как еще можно определить риск рождения ребенка с синдромом Дауна
Помимо узи-признаков для определения степени риска используют биохимический скрининг в первом и втором триместре. При этом исследуется кровь беременной женщины. Лучшие результаты дает комбинирование ультразвуковых и биохимических признаков. Если комбинация факторов является угрожающей, может быть принято решение о проведении инвазивных методик диагностики синдрома Дауна и других хромосомных аномалий. Инвазивные методики заключаются в получении частиц кожи или крови плода с последующим генетическим анализом. Такие методики являются достоверными на 100%. В то же время, даже полное благополучие при проведении скрининга в первом и втором триместре с применением узи и биохимических маркеров не может дать стопроцентной гарантии отсутствия хромосомных аномалий у плода. Выбор и определение достаточности методов диагностики осуществляется с учетом возраста родителей, семейного анамнеза и наличия отклонений во время предыдущих беременностей.
Мы вполняем все виды узи-диагностики:
3D и 4D узи при беременности
Данные фетометрии в различных сроках
Узи-диагностика синдрома Дауна и других хромосомных аномалий
Оценка правильного развития плода по УЗИ
Гидротубация (эхогидротубация): исследование проходимости маточных труб (ультразвуковая гистеросальпингоскопия)
Трансвагинальное
Яичников
Матки
Молочных желез
Дуплексное сканирование
Сосудов головного мозга
Сосудов шеи (дуплексное ангиосканирование магистральных артерий головы)
Вен нижних конечностей
Трансректальное (трузи): предстательной железы
Мошонки (яичек)
Сосудов полового члена
Аппендицит
Брюшной полости
Желчного пузыря
Желудка
Кишечника
Мочевого пузыря
Мягких тканей
Поджелудочной железы
Печени
Почек
Суставов
Щитовидной железы
Эхокардиография (узи сердца)
Варикоз: УЗИ-диагностика варикозного расширения вен
Гипертония: УЗИ-диагностика гипертонии
Тромбоз: УЗИ-диагностика тромбоза вен
Узи диагностика хронического панкреатита
при камнях в почках
при холецистите
Суть методики
Исследование методом ПЦР (полимеразной цепной реакции) – это важнейшее открытие молекулярной биологии. Благодаря этому анализу, у репродуктологов появился абсолютно безопасный способ определения резус-фактора плода. Совсем недавно врачам приходилось добывать материал для изучения, проникая в утробу матери. Инвазивная процедура создавала определенные риски для здоровья ребенка. Новая методика позволяет вычислить резус-фактор малыша по крови его мамы.
Как проходит определение резус-фактора плода? Женщина приходит в лабораторию, где у нее берут кровь из вены. Полученный материал пропускают через специальный аппарат, который выделяет из крови матери фрагменты ДНК ребенка. Затем выделенную клетку исследуют на присутствие в ней гена RhD: если он обнаруживается, значит, у плода положительный резус. Соответственно, отсутствие гена говорит об отрицательной резус-принадлежности ребенка.
Медицинским сообществом такая методика признана лучшей на сегодняшний день, и по технике определения, и по срокам получения результата. Кровеносная система эмбриона начинает формироваться с 6-8 недели беременности, с этого же срока врачи могут определить его резус. Такая ранняя диагностика позволяет вовремя узнать о резус-конфликте и принять необходимые лечебные меры по снижению риска серьезных последствий.
Для чего проводят скрининг беременным?
Скрининг (от английского screen – просеивать, отбирать) позволяет по ряду признаков выделить группы женщин, у которых возможны осложнения беременности и высокий риск развития пороков плода.
Основная задача скрининга – определение вероятности рождения ребенка с тяжелыми патологиями: хромосомными нарушениями и дефектами развития нервной системы.
Обнаружение методами скрининга повышенного риска развития пороков плода не является окончательным диагнозом. При подозрении на тяжелую патологию у плода для подтверждения или отклонения диагноза проводят дополнительные исследования инвазивными способами. Биологический материал (ворсины хориона, клетки плаценты, амниотическую жидкость) получают в результате пункции (прокола) матки через брюшную стенку.
Исследования в рамках скрининга врожденных пороков плода включают:
- Проведение УЗИ с целью выявления признаков аномалий развития плода.
- Биохимический анализ крови на специфические показатели.
- Комбинированный скрининг – сочетание биохимических и УЗИ- методов.
Высокий риск развития врожденных патологий плода существует при наличии следующих условий:
- Если женщина старше 35 лет, а возраст отца превышает 40 лет.
- При рождении в семье или у кровных родственников детей с наследственными генетическими заболеваниями: умственная отсталость, задержка физического развития, слепота, глухота, дисплазия соединительной ткани, пороки развития сердца, сосудов, опорно-двигательного аппарата.
- У супругов, состоящих в близкородственном браке (двоюродные брат, сестра).
- При патологическом течении предыдущих беременностей: мертворождения, выкидыши.
- У беременных, переболевших в первом семестре каким-либо инфекционным заболеванием.
- При воздействии на плод тератогенных (уродующих) факторов внешней среды: ионизирующее излучение, химические вещества, некоторые группы лекарств, вредные привычки (курение, алкоголь, наркотики) – особенно на ранних сроках беременности.
Аномалии половых хромосом
Наиболее частыми аномалиями половых хромосом является синдром Тернера (моносомия Х, или 45, Х0, мозаицизм) и синдром Кляйнфельтера (47, ХХУ). Это может быть обусловлено тем обстоятельством, что кариотипы 47, ХХХ и 47, ХVV не имеют выраженных фенотипических различий и поэтому идентифицируются реже.
Синдром Тернера (Шерешевского – Тернера) может быть вызван потерей родительской хромосомы, мозаицизмом (45, Х / 46, ХХ или 45, Х / 46, ХУ) или структурными аномалиями Х-хромосомы (делеции, изохромосомы).
Индивиды с синдромом Тернера имеют женский фенотип, дисгенезию гонад, низкий рост, первичные, отсутствие вторичных половых признаков, крыловидные складки шеи, низко расположенные уши, низкую заднюю границу роста волос, дискообразную грудную клетку с широкой расстоянием между сосками, аномалии почек, лимфедему конечностей при рождении и кардиоваскулярные аномалии, чаще коарктацию аорты. Но при ультразвуковом исследовании может проявляться только одна аномалия — кистозная гигрома. Скрининг-теста синдромом Тернера еще не существует, и поэтому частота рецидивов не определена.
В случае синдрома Кляйнфельтера развитие яичек сначала является нормальным. Но присутствие не менее 1 лишней Х-хромосомы приводит к гибели зародышевых клеток на этапе их поступления в мейоз, что приводит к уменьшению яичек и гиалинизации семенных протоков. Итак, классические симптомы синдрома Кляйнфельтера включают бесплодие, гинекомастию, задержку умственного развития, повышения уровня гонадотропинов вследствие уменьшения уровня циркулирующих андрогенов. Скрининг-теста по выявлению синдрома Кляйнфельтера также не существует, следовательно, пренатальный диагноз этих хромосомных аномалий возможно только при использовании биопсии хориона или амниоцентеза.
Где и когда берут ДНК плода для анализа?
Внутриутробное развитие плода сопровождается постоянным обновлением его клеток, при этом ДНК из отмирающих клеток эмбриона (фетальная ДНК) поступает в материнский кровоток. ДНК плода можно выделить и исследовать уже на 5-й неделе гестации, и практически всегда — после 9-ой недели. В крови беременной содержится 10–15% фетальной ДНК, и чем больше срок беременности, тем выше концентрация ДНК плода. Поэтому:
- для анализа используется кровь беременной женщины;
- тест NACE рекомендуется проводить не раньше 9-10 недели беременности;
- возможно проведение исследования одновременно с первым пренатальным скринингом.
Показания для тестирования на ломкую Х-хромосому
- Индивиды с задержкой умственного и общего развития, аутизмом
- Индивиды с чертами фрагильной Х-хромосомы
- Индивиды с наличием синдрома фрагильной Х-хромосомы в семейном анамнезе
- Индивиды с наличием в семейном анамнезе недиагностированной задержки умственного развития
- Плоды от матерей-носителей
Геномный импринтинг — процесс, при котором активация гена происходит преимущественно в материнской или преимущественно в родительской хромосоме, но не в обеих хромосомах. Нормальное развитие имеет место лишь в том случае, если присутствуют обе копии (материнская и отцовская) импринтинг-ген. Импринтинг-ген неактивен, значит, активный ген теряет (путем делеции) или получает мутацию, в таком случае плод будет пораженным. Лишь несколько генов могут испытывать импринтинга. Примерами геномного импринтинга может быть синдром Ангельмана и полный пузырный занос (вариант гестационной трофобластической болезни).
Синдром Ангельмана характеризуется тяжелой задержкой умственного развития, атаксической походкой, типичным лицом, пароксизмами смеха и судорогами. Ген синдрома Ангельмана является активным только в материнской унаследованной хромосоме, следовательно, если происходит делеция материнской хромосомы 15 или материнская копия гена имеет мутацию, белковый продукт не образуется и плод будет пораженным.
Синдром Ангельмана также может развиться, если обе копии хромосомы 15 является унаследованными от отца (отсутствие материнской копии хромосомы 15). Это состояние получило название унипарентальной дисомии. Унипарентальная дисомия возникает чаще вследствие потери хромосомы у эмбриона с трисомией или добавления хромосомы у плода с моносомией по этой хромосомой. Каждая из хромосом может быть генетически различной (гетеродисомия) или идентичной (изодисомия), в зависимости от времени возникновения этого феномена — в течение первого или второго мейотического деления, соответственно.
Полный пузырный занос обычно является диплоидным (46, ХХ или Х ¥), но может иметь полностью отцовское происхождение, без материнского хромосомного материала. При таких условиях плод не может развиваться. Полный пузырный занос может сопровождать нормальную многоплодную беременность, но в этом случае возрастает риск материнских осложнений (гипертиреоидизм, преэклампсия, преждевременные роды). В отличие от полного пузырного заноса, частичный пузырный занос обычно является триплоидным (69, ХХХ, 69, ХVV), с дополнительным набором отцовских хромосом.
Триплоидия с дополнительным набором материнских хромосом имеет место при ЗВУР плода, врожденных пороках развития и маленькой плаценте.
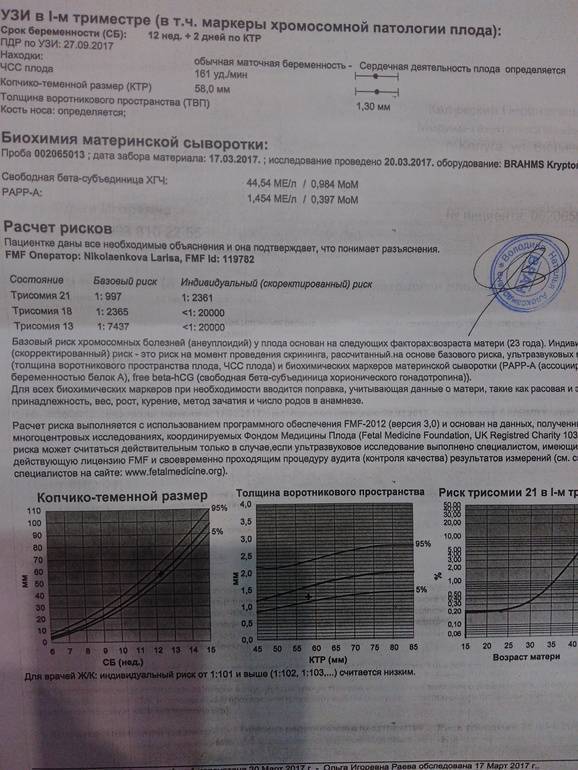
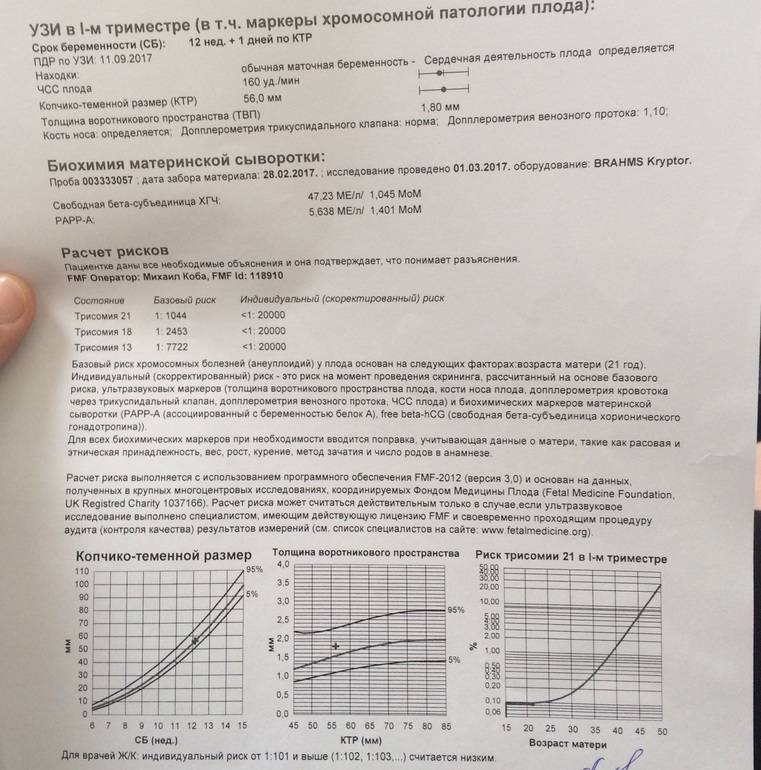
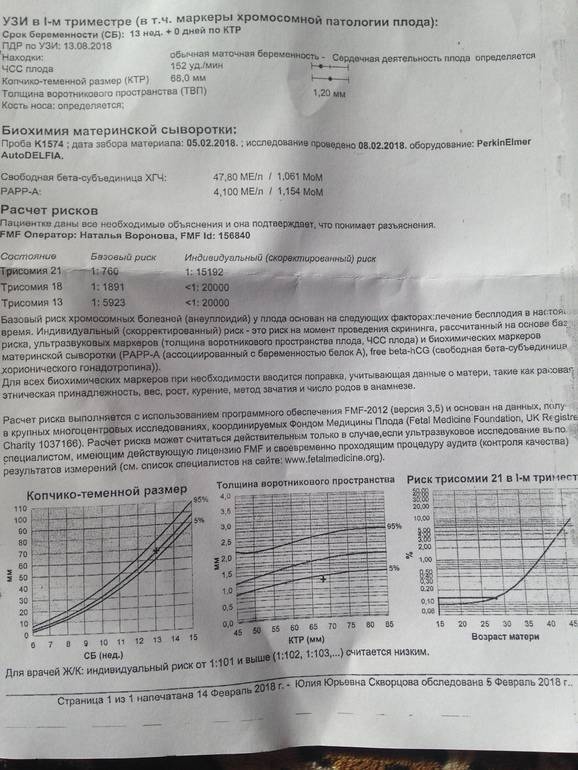
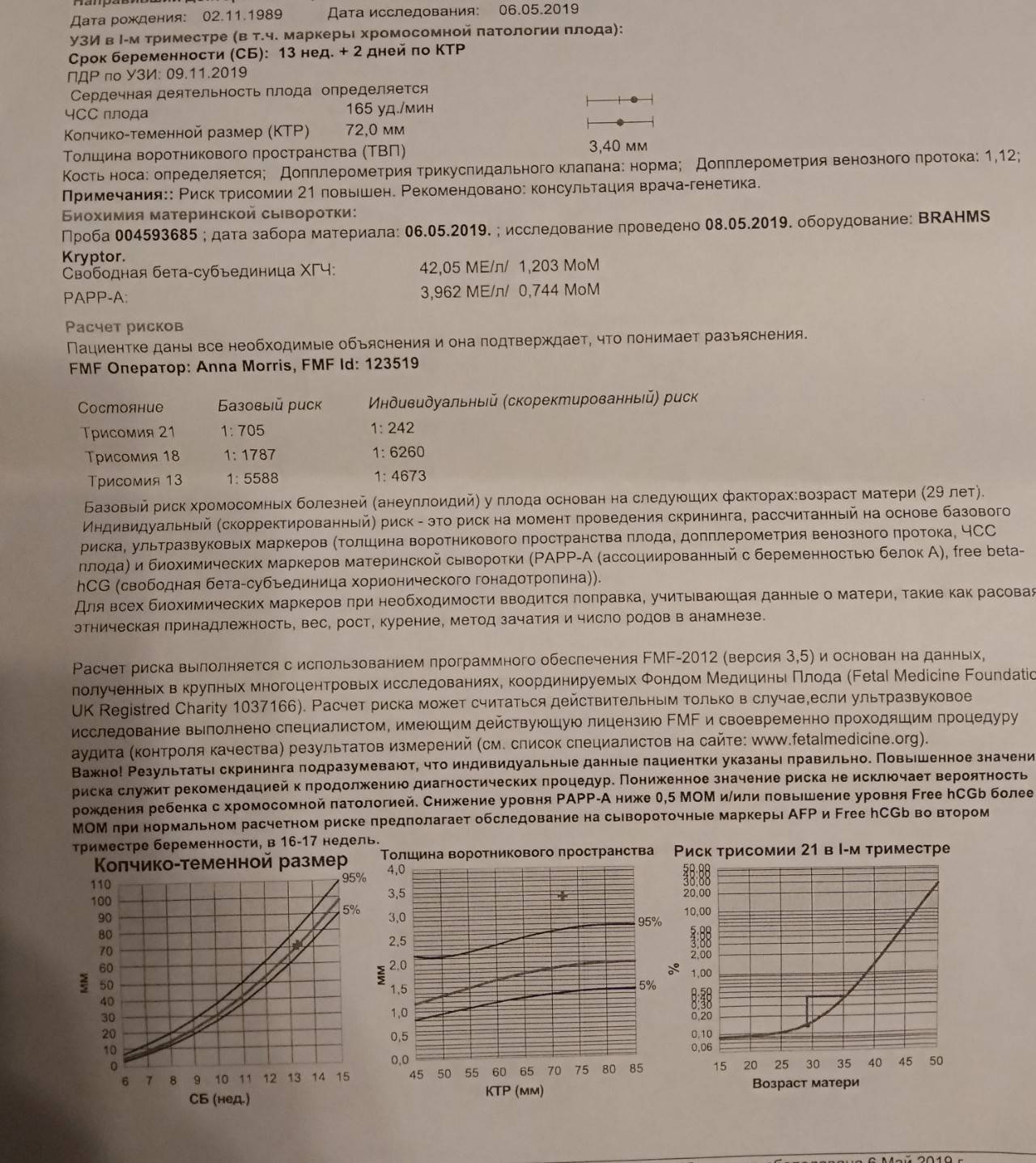
Расшифровка результатов, риски хромосомных патологий
Расшифровать результаты можно только в специальной компьютерной программе, которая необходима для этих целей. Как правило, она разрабатывается индивидуально для конкретной лаборатории, поэтому рекомендуется проходить все исследования в одной клинике. Сделать вывод о риске хромосомных аномалий, полагаясь только на результаты анализа или УЗИ, невозможно. Врачи оценивают все в комплексе, чтобы получить более точный прогноз.
Низкий уровень PAPP-A и высокий бета-ХГЧ дают все основания задуматься о возможном синдроме Дауна у ребенка. Пониженный уровень бета-ХГЧ сигнализирует о наличии синдрома Эдвардса. Оценивают абсолютно все УЗ-маркеры и показатели крови: ингибин А, эстриол, лактоген. После получения плохих результатов требуется прохождение повторного УЗИ и инвазивных исследований для подтверждения или опровержения диагноза. Если в ходе ультразвукового исследования мутаций не выявлено, то рекомендуется сделать повторный анализ на патологию плода или подождать скрининга второго триместра.
Значение результатов 1:100 считается высоким, 1:1000 – средним, т. е. вероятность аномалии все же сохраняется. Пороговый риск хромосомной патологии 1:100000 означает отсутствие патологий, т. е. ребенок родится абсолютно здоровым (с точки зрения генетики).
Как проявляется синдром Дауна после рождения?
Дети с синдромом Дауна имеют ряд внешних отличий. Их лица более плоские, со слабо выраженной переносицей и складкой эпикантуса у внутренних углов глаз. Череп ребенка укорочен, с плоским затылком.После рождения дети с синдромом Дауна несколько отстают в физическом и умственном развитии. Со временем отставание в умственном развитии, в сравнении с другими детьми, будет все более заметным.Кроме того, люди с синдромом Дауна чаще страдают врожденными пороками сердца (отмечаются почти в 40% случаев). Наличие лишней хромосомы значительно увеличивает риск развития некоторых других заболеваний: катаракты, Альцгеймера, миелоидного лейкоза, часто встречают нарушения в работе пищеварительной системы. Ослабленный иммунитет делает людей с синдромом более уязвимыми перед вирусами и простудными заболеваниями.
Дальнейшая терапевтическая тактика при обнаружении аномалий или их высоком риске
После выявления высокого риска рождения ребенка с генетическими мутациями по расшифровке результатов требуется пройти полное медицинское обследование. Лучше провести скрининг сразу в этой же лаборатории (при риске 1:100 и выше), а далее обратиться к генетику за консультацией. Специалист назначит дополнительные инвазивные исследования в зависимости от срока беременности. Результаты будут готовы через 1–3 недели.
При подтвержденных аномалиях плода на 14–16 неделе, вероятнее всего, придется прервать беременность. Если же патологии выявлены позже (после 20 недели), то вызывают искусственные роды. В некоторых случаях родители решаются сохранить беременность, принимая особенности ребенка.
Анализ крови и УЗИ – самые главные процедуры, проводимые в период вынашивания малыша. Исследования помогают выявить множество нарушений, в числе которых и хромосомные аномалии. Они могут быть как тяжелыми, так и более легкой степени. В зависимости от показателя риска развития таких патологий врачи и будущие родители принимают решение о дальнейшей судьбе ребенка.
Дети с хромосомной патологией
Дети с хромосомной патологией имеют определенные внешние признаки. Синдром Дауна характеризуется косыми глазными щелями, плоской переносицей, плоским профилем лица. Плоский профиль лица встречается почти у 90% детей с синдромом Дауна, плоская переносица встречается у 65% больных детей. Дети с хромосомной патологией, синдромом Дауна, имеют отличительные черты – открытый рот, слегка высунутый язык, эпикант, характерный низкий рост волос на затылке, также на затылке отмечается излишняя кожа. Эти признаки патологии встречаются в 80% случаев синдрома Дауна, в 60% случаев отмечаются диспластические уши, короткие пальцы, узкое нёбо. У ребенка с синдромом Дауна изменяется форма зубов – они приобретают вид острых клыков, изменяется внешний вид языка – язык напоминает географический рельеф, ему присваивают название – «географический язык». Синдрому Дауна сопутствуют многие нарушения развития – умственная отсталость, мышечная гипотония, которая встречается в 80% случаев патологии. Патология развития сердца при синдроме Дауна выявляется в среднем у 50% больных детей. Дети с хромосомной патологией синдром Дауна имеют сниженный иммунитет.
Хромосомная патология синдром Дауна имеет несколько форм:
- Простая форма – хромосомная патология синдром Дауна, хромосома 47.ХХ. 21+. Хромосомная патология простой формы встречается часто – в 95% случаев синдрома Дауна.
- Мозаичная форма – хромосомная патология синдром Дауна, хромосома 47. ХY.21+/46. ХY, встречается редко, в 1% случаев патологии.
- Транслокационная форма – хромосомная патология синдром Дауна, хромосома 47.ХХ.t 21|15; а также 47. XY/t 21/21, встречается примерно в 4% случаев этой патологии. В случае Робертсоновской транслокации возможно рождение у носителей генетической транслокации,ребенка с синдромом Дауна:
- 45.ХХ.t 21/15 (мать) – от 10 до 15%.
- 45.ХY.t 21/15 (отец) – от 5 до 7%.
- 45.ХY.t 21/21 (любой из родителей) – 100%.
Дети с синдромом Дауна, должны проходить стимуляцию центральной нервной системы – специфическую и неспецифическую, хирургическое лечение, если оно показано. Дети с синдромом Дауна, как правило, очень послушны и исполнительны. При правильном воспитании они могут ухаживать за собой, ухаживать за домашними животными, хорошо читать, петь, полностью повторять действия взрослого во время выполнения работ. Дети с хромосомной патологией должны проходить социальную реабилитацию для адаптации в обществе, специальное обучение, при достижении определенного возраста – посильное трудоустройство.
Определение маркеров в крови беременной женщины
Биохимический скрининг подразумевает анализ крови матери, в котором выявляют определенные вещества, которые появляются при наличия генетических отклонений у плода. Их доля постоянно меняется в зависимости от срока беременности.
Биохимический скрининг проводится в два этапа:
- В первом триместре беременности – на содержание свободной β-субъединицы хорионического гонадотропина человека (ХГЧ) и плазменного протеина А, связанного с беременностью (PPP-A);
- Во втором триместре – на содержание ХЧГ или свободной β-субъединицы ХГЧ, свободного эстриола, ингибина А и альфа-фетопротеина (АФП).
Для каждого из перечисленных выше веществ есть некоторые нормы содержания в крови в зависимости от срока беременности. Отклонения в количестве маркеров от определенных норм не подтверждает на 100% генно-хромосомной болезни, а лишь указывает на высокий риск генетических пороков и аномалий. Поэтому, исследование дополняется результатами УЗИ плода. А если остаются сомнения, потребуется дополнительное обследование инвазивными методами.
Кроме данных анализов крови, при биохимическом скрининге учитываются также ряд общих данных о беременной (особенно важную роль играет возраст) и показания УЗИ, сделанного на том же самом сроке. Так или иначе, в качестве результата выдается лишь вероятность существования генетического заболевания у будущего ребенка. Достоверные сведения можно получить лишь в результате инвазивных процедур, то есть амниоцентеза, кордоцентеза или биопсии ворсинок хориона.
Что такое Синдром Дауна
Патология подразумевает врожденную, генетически обусловленную, а значит неизлечимую, задержку физического и психического развития. У таких детей нарушается рост костей, что приводит к изменению строения тела.
У детишек с СД характерная внешность:
- маленькая округлая головка;
- раскосые, суженные, припухшие глаза, уши и нос меньше нормы, губы утолщены, язык удлиненный;
- рост низкий, укороченные пальцы;
- кожа отечная, волосы истончены;
- половые органы недоразвиты.
Умственное развитие человека с СД даже во взрослом возрасте сохраняется на уровне дошкольника — это главная причина, по которой многие семейные пары выбирают аборт.
При этом нужно отметить, что люди с этим диагнозом очень добрые, ласковые, любят животных и с усердием занимаются разными простыми делами. За открытость и беззлобие их называют «солнечными». Многие из пациентов могут себя обслуживать самостоятельно — одеваться, убирать за собой посуду. Некоторые считают и читают на уровне первоклашек. Но выжить без опекуна они не смогут.
Биохимический скрининг второго триместра («Тройной тест»)
Биохимический скрининг второго триместра проводится в 15-20 недель, оптимально проведение в 16-18 недель.
В этом сроке определяется три показателя: АФП, ХГЧ и НЭ (неконъюгированный эстриол). Также как и в первом триместре определяются уровень этих веществ и МоМ.
Иногда во втором триместре ограничиваются лишь определением АФП и ХГЧ, либо вообще только АФП. Диагностическая ценность теста при этом значительно снижается.
При синдроме Дауна обычно АФП снижен, а ХГЧ повышен. При синдроме Эдвардса АФП нормальный, а ХГЧ низкий. При дефектах развития нервной трубки повышен АФП, остальные показатели в норме. Повышение АФП может быть также при дефектах заращения передней брюшной стенки и при аномалиях почек у плода. Диагностически значимым может считаться только повышение АФП в 2,5 и более раза.
Данный тест позволяет выявить до 90% случаев пороков развития нервной трубки. При синдроме Дауна и синдроме Эдвардса отклонения в показателях тройного теста наблюдаются лишь в 70% случаев, то есть 30% ложноотрицательных результатов. Ложноположительных результатов при этом около 10%.
В идеале тест должен оцениваться в совокупности с результатами УЗИ.
При проведении скрининга и первого, и второго триместра, с учетом результатов УЗИ, эффективность выявления дефектов нервной трубки составляет 98%, а синдромов Дауна и Эдвардса 93%, а ложноположительные результаты встречаются лишь в 1-2% случаев.
При выявлении высокого риска женщину направляют на кордоцентез.